Evolucion de los Modelos Atomicos
sábado, 6 de agosto de 2011
Origen de los Modelos Atómicos
El origen del modelo que corresponde a nuestras ideas actuales se debe a E. Rutherford, un físico de la universidad de Manchester, y fue sugerido por una famosa experiencia.
En una célebre memoria, en 1911, formuló la hipótesis de que el átomo estaba constituído por una carga eléctrica positiva central, el núcleo, en la cual debía concentrarse la casi totalidad de la masa del átomo, y por una carga negativa igual constituída por electrones girando alrededor de aquél.
La carga positiva del núcleo, que por sus dimensiones es prácticamente puntiforme, podía ejercer sobre una partícula o incidente (también positiva), dirigida contra aquél, una fuerza repulsiva suficiente para producir grandes desviaciones.
Rutherford calculó la carga positiva Z del núcleo en unidades correspondientes a la carga del electrón: encontró que ésta era aproximadamente igual a la mitad del peso atómico y pudo también evaluar el radio del núcleo.
Examinando más detalladamente el modelo de Rutherford y considerando el caso más simple, o sea el átomo de hidrógeno formado por el núcleo y un electrón, suponiendo que éste gire alrededor del núcleo en una órbita circular de radio r, la fuerza centrípeta necesaria para mantener el electrón en la órbita estará constituida por la fuerza coulombiana de interacción entre la carga positiva + e del núcleo y la carga negativa – e del electrón. En estas condiciones el electrón posee una energía potencial porque se encuentra en el campo eléctrico del núcleo y una energía cinética debida a su movimiento.
Desde hacia tiempo se había comprobado que los átomos, en ciertas condiciones, pueden irradiar en el espacio energía electromagnética; el estudio de esta radiación, la espectroscopía, disponía de una gran cantidad de resultados experimentales. Se había descubierto con el análisis espectroscópico que la radiación emitida de un gas excitado mediante una descarga eléctrica o por un arco entre electrones de materiales diferentes, estaba constituída por radiaciones cuyas frecuencias eran bien definidas y características de las sustancias componentes del gas o los electrones del arco. La radiación emitida presentaba, pues, un espectro de rayos, cada una de las cuales correspondía a una determinada frecuencia.
Admitido que el electrón gira alrededor del núcleo, una de las magnitudes que caracterizan a un movimiento de ese tipo es el momento angular respecto del núcleo, o sea el producto m v r, que obedece a un principio de conservación y cuyas dimensiones son las de una acción.
Evolución Histórica
Demócrito y otros filósofos griegos, fueron probablemente los primeros en creer que la materia estaba constituida por partículas que denominaron átomos, palabra que significa "sin división", ya que consideraban el átomo como único e indivisible. Se basaba, no en pruebas experimentales, sino en un razonamiento que puede sintetizarse así: un trozo de metal puede cortarse en 2 pedazos y cada uno de éstos en dos pedazos más; estos pueden dividirse sucesivamente hasta llegar a un momento en que se obtenga una partícula que ya no sea posible dividir: el átomo. Pensaban que los átomos tendrían formas y tamaños distintos: esféricos, cilíndricos, irregulares... El conocimiento del tamaño y la naturaleza del átomo avanzó muy lentamente a lo largo de los siglos ya que la gente se limitaba a especular sobre él.
Con la llegada de la ciencia experimental en los siglos XVI y XVII, los avances en la teoría atómica se hicieron más rápidos. Los químicos se dieron cuenta muy pronto de que todos los líquidos, gases y sólidos pueden descomponerse en sus constituyentes últimos, o elementos. Por ejemplo, se descubrió que la sal se componía de dos elementos diferentes, el sodio y el cloro, ligados en una unión íntima conocida como compuesto químico. El aire, en cambio, resultó ser una mezcla de los gases nitrógeno y oxígeno.
Teoría de Dalton
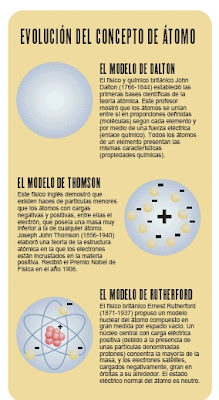
John Dalton, profesor y químico británico, estaba fascinado por el rompecabezas de los elementos. A principios del siglo XIX estudió la forma en que los diversos elementos se combinan entre sí para formar compuestos químicos. Recogió la idea del átomo que dio el filosofo Demócrito, si bien esta vez basándose en métodos experimentales. Aunque muchos otros científicos, empezando por los antiguos griegos, habían afirmado ya que las unidades más pequeñas de una sustancia eran los átomos, se considera a Dalton como una de las figuras más significativas de la teoría atómica porque la convirtió en algo cuantitativo. Dalton mostró que los átomos se unían entre sí en proporciones definidas. Sin embargo, a la primera obra de Dalton, Observaciones y ensayos meteorológicos (1793), se le prestó muy poca atención. Las investigaciones demostraron que los átomos suelen formar grupos llamados moléculas. Cada molécula de agua, por ejemplo, está formada por un único átomo de oxígeno (O) y dos átomos de hidrógeno (H) unidos por una fuerza eléctrica denominada enlace químico, por lo que el agua se simboliza como HOH o H2O.
Todos los átomos de un determinado elemento tienen las mismas propiedades químicas. Por tanto, desde un punto de vista químico, el átomo es la entidad más pequeña que hay que considerar. Las propiedades químicas de los elementos son muy distintas entre sí; sus átomos se combinan de formas muy variadas para formar numerosísimos compuestos químicos diferentes. Algunos elementos, como los gases nobles helio y argón, son inertes; es decir, no reaccionan con otros elementos salvo en condiciones especiales. Al contrario que el oxígeno, cuyas moléculas son biatómicas (formadas por dos átomos), el helio y otros gases inertes son elementos monoatómicos, con un único átomo por molécula.
Hacia el 1800, Dalton, mediante el estudio de las leyes ponderales, concluye que:
• La materia está constituida por partículas indivisibles (átomos),
• Todos los átomos de un mismo elemento químico son iguales,
• Los átomos de elementos diferentes son también diferentes.
En 1803, estudiando algunas de las propiedades de los gases llegó a la ley de las proporciones múltiples, considerada como la primera prueba indirecta de la realidad de los átomos.
Las especulaciones de Dalton puede resumirse en tres puntos:
• Todas las sustancias, elementos y compuestos están constituidos por agregaciones de partículas que son iguales en dimensiones y peso para cada elemento.
• Una combinación química consiste sólo en una agrupación de estas partículas, sin variación alguna de su peso.
• En las combinaciones la agrupación de los átomos tiene lugar de modo simple, en el sentido de que un átomo de una sustancia A puede combinarse con un átomo de una sustancia B o con dos, tres, etc. dando lugar a los compuestos.
Las propiedades químicas y físicas de los elementos no dependen del peso atómico, sino de la estructura de la atmósfera electrónica que circunda el núcleo de sus átomos. Dicha estructura se halla estrechamente relacionada con el número atómico que corresponde al número de orden que ocupan los elementos en el sistema periódico de Mendeléiev y representa la carga del núcleo en unidades correspondientes a la carga del electrón.
En 1808 se publicó su obra Nuevo sistema de filosofía química, que incluía las masas atómicas de varios elementos conocidos en relación con la masa del hidrógeno. Sus masas no eran totalmente precisas pero constituyen la base de la clasificación periódica moderna de los elementos. Dalton llegó a su teoría atómica a través del estudio de las propiedades físicas del aire atmosférico y de otros gases. En el curso de la investigación descubrió la ley conocida como 'ley de Dalton de las presiones parciales”, según la cual, la presión ejercida por una mezcla de gases es igual a la suma de las presiones parciales que ejercería cada uno de los gases si él solo ocupara el volumen total de la mezcla. Dalton fue elegido miembro de la Sociedad Real de Londres en 1822 y cuatro años más tarde se le concedió la medalla de oro de esta sociedad. En 1830 Dalton se convirtió en uno de los ocho socios extranjeros de la Academia de Ciencias Francesa. Murió el 27 de julio de 1844 en Manchester.
Ley de Avogadro
El estudio de los gases atrajo la atención del físico italiano Amedeo Avogadro quien, en 1811, formuló una importante ley que lleva su nombre. Esta ley afirma que dos volúmenes iguales de gases diferentes contienen el mismo número de moléculas si sus condiciones de temperatura y presión son las mismas. Si se dan esas condiciones, dos botellas idénticas, una llena de oxígeno y otra de helio, contendrán exactamente el mismo número de moléculas. Pero, el número de átomos de oxígeno será dos veces mayor puesto que el oxígeno es diatómico.Modelo atómico de Thompson
Sir Joseph John Thompson (1856−1940) fue un físico británico, premiado con el Nóbel. Nació cerca de Manchester, Lancashire, y estudió en el Owens College (hoy parte de la Universidad de Manchester) y en el Trinity College, de la Universidad de Cambridge. En esta institución enseñó matemáticas y física, fue profesor de física experimental en el laboratorio de Cavendish, y rector del Trinity College (1918−1940) También fue presidente de la Sociedad Real (1915−1920) y profesor de filosofía natural de la Institución Regia de Gran Bretaña (1905−1918)En 1897 Thompson realiza una serie de experimentos y descubre el electrón. En tubos de gases a baja presión en los que se establece una diferencia de potencial superior a 10.000 voltios, se comprobó que aparecían partículas con carga eléctrica negativa a las que se llamó electrones, y demostró que habían sido arrancados de los átomos (los cuales eran neutros) Tal descubrimiento modificó el modelo atómico de Dalton, que lo consideraba indivisible. Thompson supuso el átomo como una esfera homogénea e indivisible cargada positivamente en la que se encuentran incrustados los electrones. En 1906 Thompson recibió el Premio Nóbel de Física por su trabajo sobre la conducción de la electricidad a través de los gases. Se le considera el descubridor del electrón por sus experimentos con el flujo de partículas (electrones) que componen los rayos catódicos. Teórico y un experimentador, Thompson elaboró en 1898 la teoría del pudín de ciruelas de la estructura atómica, en la que sostenía que los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva. En 1908 fue nombrado Sir.
Modelo atómico de Rutherford
Rutherford of Nelson, Lord Ernest (1871−1937) fue un físico británico, premio Nóbel por su trabajo en física nuclear y por su teoría de la estructura del átomo. Nació el 30 de agosto de 1871, en Nelson, Nueva Zelanda y estudió en la Universidad de Nueva Zelanda y en la de Cambridge. Fue profesor de física en la Universidad McGill de Montreal, Canadá, desde 1898 a 1907 y en la de Manchester, en Inglaterra, durante los 12 años siguientes. A partir de 1919 ejerció como profesor de física experimental y director del Laboratorio Cavendish en la Universidad de Cambridge y también mantuvo una cátedra, a partir de 1920, en la Institución Real de Gran Bretaña en Londres.Rutherford, teniendo en cuenta los descubrimientos anteriores, enuncio el siguiente modelo: el átomo está formado por un núcleo cargado positivamente (protones) y por electrones negativamente cargados girando alrededor de él.
El átomo es neutro porque el número de electrones negativos sería igual al de las cargas positivas del núcleo. Investigaciones posteriores llevaron a determinar que en el núcleo, además de protones, tenían que existir otras partículas. Como el electrón tiene una masa prácticamente nula y la masa del protón es aproximadamente la mitad del peso atómico, debía existir dentro del núcleo otra partícula con masa aproximadamente igual a la del protón. A esa partícula eléctricamente neutra se la denominó neutrón. Rutherford realizó una serie de experimentos. Hizo incidir sobre una lámina finísima de oro un delgado haz de partículas cargadas positivamente de masa mucho mayor que el electrón y dotadas de energía cinética alta. En el choque observó distintos comportamientos:
La mayoría de los rayos alfa atravesaba la lámina sin desviarse, porque igual que en caso de la reja, la mayor parte del espacio de un átomo es espacio vacío.
Algunos rayos se desviaban, porque pasan muy cerca de centros con carga eléctrica del mismo tipo que los rayos alfa (CARGA POSITIVA).
Muy pocos rebotan, porque chocan frontalmente contra esos centros de carga positiva.
Esta experiencia implicaba:
• Que los átomos estaban casi vacíos, pues la mayoría de las partículas las atravesaban
• Que hay una zona cargada positivamente, ya que algunas partículas retrocedían o se desviaban. Esta zona debe estar muy concentrada ya que es mayor el número de desviaciones que de choques.
Esto le condujo a proponer en 1911 un nuevo modelo atómico en el que se afirmaba que los átomos estaban constituidos por 2 zonas bien diferenciadas:
• Una de carga positiva con el 99,9% de la masa muy concentrada y por tanto de gran densidad a la que llamó núcleo.
• Otra rodeando al núcleo a la que llamó corteza donde estaban los electrones con carga negativa girando alrededor del núcleo.
Sin embargo, el modelo de Rutherford presentaba fallos:
Según la teoría clásica de electromagnetismo, una partícula eléctrica acelerada emite energía y el electrón, girando en torno al núcleo, está sometido a una aceleración centrípeta por lo que irradiaría energía, perdería velocidad y, por fin, caería al núcleo desestabilizando el átomo. Pero como el átomo de hecho es estable, las cosas no pueden ocurrir según el modelo de Rutherford.
Una serie de descubrimientos importantes realizados hacia finales del siglo XIX dejó claro que el átomo no era una partícula sólida de materia que no pudiera ser dividida en partes más pequeñas.
Como resultado de las investigaciones del físico británico Ernest Rutherford y sus coetáneos, se demostró que el uranio y algunos otros elementos pesados, como el torio o el radio, emiten tres clases diferentes de radiación, inicialmente denominadas rayos alfa (a), beta (b) y gamma (g). Las dos primeras, que según se averiguó están formadas por partículas eléctricamente cargadas, se denominan actualmente partículas alfa y beta. Posteriormente se comprobó que las partículas alfa son núcleos de helio y las partículas beta son electrones. Estaba claro que el átomo se componía de partes más pequeñas. Los rayos gamma fueron finalmente identificados como ondas electromagnéticas, similares a los rayos X pero con menor longitud de onda.
Teoría De Planck
En 1900 emitió una hipótesis que interpretaba los resultados experimentales satisfactoriamente como los cuerpos captaban o emitían energía. Según Planck, la energía emitida o captada por un cuerpo en forma de radiación electromagnética es siempre un múltiplo de la constante h, llamada posteriormente constante de Planck por la frecuencia v de la radiación.e = nhv
h = 6,62 10-34 J•s, constante de Planck
v = frecuencia de la radiación
A hv le llamó cuanto de energía. El hecho de que un cuanto sea más energético que otro dependerá de su frecuencia.
Modelo atómico de Bohr
El modelo atómico nuclear postulado por Rutherford no prosperó pues entraba en contradicción con algunos postulados de la física clásica. El físico danés Niels Bohr estableció una serie de postulados (basados en la teoría de Planck y los datos experimentales de los espectros) que constituyen el modelo atómico de Bohr.
Los postulados establecidos por Bohr fueron los siguientes:
• El electrón se puede mover sólo en determinadas órbitas, caracterizadas por su radio.
• Cuando el electrón se encuentra en dichas órbitas, el sistema no absorbe ni emite energía (órbitas estacionarias).
• Al suministrarle al átomo energía externa, el electrón puede pasar o “exitarse” a un nivel de energía superior, correspondiente a una órbita de mayor radio.
• Durante la caída del electrón de un nivel de mayor energía (más alejado del núcleo) a uno de menor energía (más cerca del núcleo) se libera o emite energía.
Para explicar la estructura del átomo, desarrolló en 1913 una hipótesis conocida como teoría atómica de Bohr. Supuso que los electrones están dispuestos en capas definidas, o niveles cuánticos, a una distancia considerable del núcleo. La disposición de los electrones se denomina configuración electrónica. El número de electrones es igual al número atómico del átomo: el hidrógeno tiene un único electrón orbital, el helio dos y el uranio 92. Las capas electrónicas se superponen de forma regular hasta un máximo de siete, y cada una de ellas puede albergar un determinado número de electrones. La primera capa está completa cuando contiene dos electrones, en la segunda caben un máximo de ocho, y las capas sucesivas pueden contener cantidades cada vez mayores. Ningún átomo existente en la naturaleza tiene la séptima capa llena. Los "últimos" electrones, los más externos o los últimos en añadirse a la estructura del átomo, determinan el comportamiento químico del átomo.
Todos los gases inertes o nobles (helio, neón, argón, criptón, xenón y radón) tienen llena su capa electrónica externa. No se combinan químicamente en la naturaleza, aunque los tres gases nobles más pesados (criptón, xenón y radón) pueden formar compuestos químicos en el laboratorio. Por otra parte, las capas exteriores de los elementos como litio, sodio o potasio sólo contienen un electrón. Estos elementos se combinan con facilidad con otros elementos (transfiriéndoles su electrón más externo) para formar numerosos compuestos químicos. De forma equivalente, a los elementos como el flúor, el cloro o el bromo sólo les falta un electrón para que su capa exterior esté completa. También se combinan con facilidad con otros elementos de los que obtienen electrones.
Las capas atómicas no se llenan necesariamente de electrones de forma consecutiva. Los electrones de los primeros 18 elementos de la tabla periódica se añaden de forma regular, llenando cada capa al máximo antes de iniciar una nueva capa. A partir del elemento decimonoveno, el electrón más externo comienza una nueva capa antes de que se llene por completo la capa anterior. No obstante, se sigue manteniendo una regularidad, ya que los electrones llenan las capas sucesivas con una alternancia que se repite. El resultado es la repetición regular de las propiedades químicas de los átomos, que se corresponde con el orden de los elementos en la tabla periódica.
Resulta cómodo visualizar los electrones que se desplazan alrededor del núcleo como si fueran planetas que giran en torno al sol. No obstante, esta visión es mucho más sencilla que la que se mantiene actualmente. Ahora se sabe que es imposible determinar exactamente la posición de un electrón en el átomo sin perturbar su posición. Esta incertidumbre se expresa atribuyendo al átomo una forma de nube en la que la posición de un electrón se define según la probabilidad de encontrarlo a una distancia determinada del núcleo. Esta visión del átomo como "nube de probabilidad" ha sustituido al modelo de sistema solar. El Orbital atómico es la región del espacio en la cual existe mayor probabilidad de encontrar al electrón. En la representación mediante orbitales existe un 90-99% de probabilidad de encontrar al electrón. En la figura se observa la representación de un orbital "s".
Como según la teoría electromagnética una carga acelerada tiene que irradiar energía, no puede haber ningún orbital permanente. Por eso, Bohr argumentaba que no se podía perder energía continuamente, sino en cuantos (de acuerdo con la teoría de Planck) equivalentes a la diferencia de energía entre las órbitas posibles.
Cuando a un átomo se le suministra energía y los electrones saltan a niveles más energéticos, como todo sistema tiende a tener la menor energía posible, el átomo es inestable y los electrones desplazados vuelven a ocupar en un tiempo brevísimo (del orden de 10-8) el lugar que dejasen vacío de menor energía, llamados niveles energéticos fundamentales.
Así pues, ya tenemos una explicación de los espectros atómicos con el modelo de Bohr. Cuando un átomo es exitado por alguna energía exterior, algún electrón absorbe dicha energía pasando de un nivel energético fundamental a niveles de energía superior. Como, según Planck, la absorción de energía está cuantizada, la diferencia de energía entre ambos niveles será hv. El electrón absorbe sólo una radiación de frecuencia v determinada que será mayor cuanto mayor sea el "salto" del electrón. Así, en el espectro de absorción aparecerá una banda continua con algunas rayas negras que corresponderán a aquellas frecuencias determinadas que los electrones han captado para pasar de un nivel a otro más energético.
Como el átomo exitado es inestable, en un tiempo brevísimo el electrón desplazado volverá al nivel energético fundamental, emitiendo una energía de la misma frecuencia hv que absorbió anteriormente. Así, el espectro de emisión del elemento estará formado por líneas definidas, situadas en la misma longitud de onda que el espectro de emisión, separadas por zonas oscuras. Ello explica por que los espectros de los vapores o gases (en los que nos encontramos los átomos o moléculas aislados sin interaccionar entre sí) son discontinuos. Es un hecho experimental que cada elemento químico tiene su espectro atómico característico.
Fue a partir de las series del hidrógeno, de las frecuencias de las distintas radiaciones emitidas, de donde Bohr dedujo los niveles de energía correspondientes a las órbitas permitidas. Sin embargo, al aplicar esta distribución de los niveles energéticos a otros elementos no se correspondían esos cálculos teóricos con los resultados experimentales de los espectros, que eran muchos más complejos. Incluso el mismo átomo de hidrógeno con espectroscopios (aparatos que muestran los espectros) más precisos producía líneas que con el modelo de Bohr no se podía explicar.
Corrección de Sommerfield
Al perfeccionarse los espectroscopios se observó que las líneas del espectro del hidrógeno eran en realidad varias líneas muy juntas y lo que Bohr creyó que eran estados únicos de energía eran varios estados muy próximos entre sí. Sommerfield lo interpretó diciendo que las órbitas podían ser elípticas. Para ello introdujo un nuevo número cuántico l, también llamado número azimutal, que puede valer:
l = 0,1,...,(n-1)
Este número nombra a cada uno de los niveles de energía posibles para cada valor de n. Según Sommerfield, para determinar la posición del electrón en el átomo de hidrógeno hay que dar 2 números cuánticos l y m.
Efecto Zeeman
Cuando se obtiene el espectro del átomo de hidrógeno mientras el gas está dentro de un campo magnético se observa un desdoblamiento de las líneas que analizó Sommerfield. Cada una de estas líneas se desdoblaba en varias. Este fenómeno desaparecía al desaparecer el campo magnético por lo que no se debe a que existan nuevos estados distintos de energía del electrón, sino que está provocado por la interacción del campo magnético externo y el campo magnético que crea el electrón al girar en su órbita.
Este problema se solucionó pensando que para algunas de las órbitas de Sommerfield existen varias orientaciones posibles en el espacio que interaccionan de forma distinta con el campo magnético externo. Para ello se creó un nuevo número cuántico magnético, que vale para cada valor de l:
M = -l,...,-1,0,1,...,+l
Para determinar pues la posición del electrón en el átomo de hidrógeno hay que dar 3 números cuánticos: n, l, m.
Efecto Zeeman Anómalo
Al perfeccionar los espectroscopios y analizar los espectros obtenidos por el efecto Zeeman, se comprobó que cada línea era en realidad dos líneas muy juntas. Esto se llamó efecto Zeeman anómalo, y si desaparecía el campo magnético externo también desaparecía este efecto.
Se explicó admitiendo que el electrón puede girar sobre sí mismo y hay dos posibles giros, que interaccionaban de forma distinta con el campo magnético externo y que por eso cada línea se desdoblaba en 2. Se creó un nuevo número cuántico s, o número de spin (giro), al que se le dio 2 valores, uno para cada sentido:
s = +1/2, -1/2
Para describir la posición de un electrón se necesitan 4 números cuánticos: (n, l, m, s). Sin embargo, todo lo anterior sólo era útil para el átomo de hidrógeno, pues su aplicación en la descripción de otros átomos fracasó.
Principio de Incertidumbre
Principio enunciado en 1927 por el alemán Werner Heisenberg según el cual no puede ser conocida con exactitud y simultáneamente la posición y la cantidad de movimiento de un electrón. Este principio tiene su origen en la mecánica cuántica según la cual el mismo hecho de medir la velocidad o la posición de un electrón implica una imprecisión en la medida. Por ejemplo, en el caso de que pudiéramos "ver" un electrón u otra partícula subatómica, para poder medir la velocidad habría que iluminarlo. Pues bien, el fotón que ilumina a ese electrón modifica la cantidad de movimiento del mismo. Por tanto, modificaría su velocidad original que es lo que queríamos medir.
En 1925 Goudmit y Ulembeck introdujeron la hipótesis de que el electrón, además de moverse alrededor del núcleo, tiene un movimiento de rotación sobre sí mismo como sucede en los planetas del sistema solar.
Modelo mecanocuántico del átomo
Una de las consecuencias deducidas del Principio de Indeterminación de Heisenberg es que la interacción entre los aparatos de medida y los objetos de la medición hace imposible determinar simultáneamente y con precisión la posición y la velocidad del electrón. De aquí se sigue la imposibilidad de hablar de trayectorias: una trayectoria significa el conocimiento de la posición de una partícula en cada instante, y de la velocidad correspondiente a cada posición. Con este punto de vista, los modelos de Bohr y Sommerfield, muy intuitivos, han de parecer forzosamente limitados. En 1924 el francés Luis de Broglie amplía al electrón (y a otras partículas) la noción de dualidad onda-corpúsculo, según la cual el electrón lleva asociada una onda electromagnética de longitud l =h/mv. La hipótesis ondulatoria de la materia y el principio de indeterminación, alteraron los conceptos de posición, velocidad y orbital electrónico. Nació así un nuevo dominio de la física, la mecánica cuántica, que explica coherentemente los fenómenos del microcosmos.
En 1926 el austríaco Schrödinger basándose en la hipótesis de Broglie y la idea de órbitas permitidas de Bohr, supone que esas órbitas debían contener un número entero de longitudes de onda, lo que daría origen a una onda estacionaria. Considerar una onda asociada al electrón explicaría la razón de ser de los orbitales posibles que Bohr estableció como postulado, cuya circunferencia sería un múltiplo de la longitud de onda de los electrones. El estado de un electrón se obtendría mediante la ecuación que Shrödinger postula en 1926. Teniendo en cuenta el principio de incertidumbre dichas ecuaciones no se pueden resolver, pero se obtiene la llamada función de onda, aproximación de carácter estadístico que nos permite deducir para cada nivel de energía la probabilidad de que los electrones estén en una u otra situación. Las órbitas electrónicas quedan sustituidas por zonas del espacio en las que existe el 99% de encontrar al electrón, a las que llamamos orbitales. Read more...